Rischi apparenti di diagnosi di sindrome da tachicardia posturale ortostatica dopo la vaccinazione COVID-19 e l'infezione da SARS-Cov-2
The HOLY BIBLE
https://holy-bible.webnode.page/
Andrea Salvatore Buffa Denunce Pubbliche 02.03.1973 PALERMO
Via Vita 12, Petro SioN TP 91020 Italy
HOMEPAGE
https://andreasalvatorebuffa2.substack.com/p/homepage-from-god
Il Santo Natale è il 2 marzo, Sofonia 1:10
Andrea Salvatore Buffa
Dec 25, 2022
https://andreasalvatorebuffa2.substack.com/p/il-santo-natale-e-il-2-marzo-sofonia-110
I AM THE EXPECTED CHRIST!
אני המשיח המצופה!
我是所期待的基督!
IO SONO IL CRISTO ATTESO!
JE SUIS LE CHRIST ATTENDU!
¡YO SOY EL CRISTO ESPERADO!
ICH BIN DER ERWARTETE CHRISTUS!
أنا المسيح المنتظر!
Я ЕСМЬ ОЖИДАННЫЙ ХРИСТОС!
मैं अपेक्षित मसीह हूँ!
私は期待されているキリストです!
https://andreasalvatorebuffa2.substack.com/p/i-am-the-expected-christ
Un gran fracasso dalle colline Sofonia 1:10
https://andreasalvatorebuffa2.substack.com/p/un-gran-fracasso-dalle-colline-sofonia-110
Napoli Franci 23/05/2024
https://andreasalvatorebuffa2.substack.com/p/napoli-franci-23052024
ASTENERSI DAI fArmAci e dal rivotarli
https://andreasalvatorebuffa2.substack.com/p/astenersi-dai-farmaci-e-dal-rivotarli
La magistratura, una farsa della CIA di Hollywood
https://andreasalvatorebuffa2.substack.com/p/la-magistratura-una-farsa-della-cia
La Verità vi accusa di complicità
https://andreasalvatorebuffa2.substack.com/p/la-verita-vi-accusa-di-complicita
HOMEPAGE
יהודי ITALIANO 中国人 FRANÇAISE ESPAÑOL
Arrestate Matteo Salvini e Giorgia Meloni !
https://andreasalvatorebuffa2.substack.com/p/arrestate-matteo-salvini-e-giorgia-35d
I gesti di riconoscimento segreti della Massoneria
https://andreasalvatorebuffa2.substack.com/p/i-gesti-di-riconoscimento-segreti
SCARICA TUTTO IL SITO
DOWNLOAD THE ENTIRE SITE
26 Maggio 2024
.
THE ARAB/ENGLISH OFFENSIVE IN ISRAEL
AND WORLD WARS!
L'OFFENSIVA ARABA/INGLESE IN ISRAELE
E LE GUERRE MONDIALI!
https://andreasalvatorebuffa2.substack.com/p/loffensivaarabainglese-in-israele
Rischi apparenti di diagnosi di sindrome da tachicardia posturale ortostatica dopo la vaccinazione COVID-19 e l'infezione da SARS-Cov-2
Fonte
https://doi.org/10.1038/s44161-022-00177-8
Ricerca
Contenuto
Di
Pubblicare
Articolo
Rischi apparenti di diagnosi di sindrome da tachicardia posturale ortostatica dopo la vaccinazione COVID-19 e l'infezione da SARS-Cov-2
Mostra autori
Nature Cardiovascular Research volume 1 , pagine 1187–1194 (2022) Cita questo articolo
80k accessi
6 citazioni
2936 Altmetrico
Astratto
La sindrome da tachicardia ortostatica posturale (POTS) è stata precedentemente descritta dopo l'infezione da coronavirus 2 (SARS-CoV-2) della sindrome respiratoria acuta grave; tuttavia, sono disponibili dati limitati sulla relazione tra POTS e vaccinazione contro la malattia da coronavirus 2019 (COVID-19). Qui mostriamo, in una coorte di 284.592 individui vaccinati con COVID-19, utilizzando un'analisi di simmetria di sequenza, che le probabilità di POTS sono più alte 90 giorni dopo l'esposizione al vaccino rispetto a 90 giorni prima dell'esposizione; mostriamo anche che le probabilità di POTS sono superiori rispetto alle diagnosi di cure primarie convenzionali di riferimento, ma inferiori alle probabilità di una nuova diagnosi di POTS dopo l'infezione da SARS-CoV-2. I nostri risultati identificano una possibile associazione tra vaccinazione COVID-19 e incidenza di POTS. Nonostante la probabile bassa incidenza di POTS dopo la vaccinazione COVID-19,
Principale
La vaccinazione contro la malattia da coronavirus 2019 (COVID-19) si è dimostrata sicura ed efficace in più studi 1 , 2 , 3 , 4 . La farmacovigilanza sui vaccini ha rivelato diversi effetti collaterali rari nel contesto della somministrazione a livello di popolazione 5 , 6 , inclusi effetti cardiovascolari fuori bersaglio, con il più ben caratterizzato essere la miocardite 7 , 8 . Sono emerse segnalazioni riguardanti casi di sindrome tachicardica ortostatica posturale (POTS) dopo la vaccinazione 9. Riconosciuta come una sindrome clinica che si manifesta con intolleranza ortostatica e tachicardia posturale, la POTS viene diagnosticata sulla base di caratteristiche cliniche, come vertigini ortostatiche, palpitazioni e pre-sincope, e un test in piedi di 10 minuti o un test del tavolo inclinato che dimostra una frequenza cardiaca elevazione di almeno 30 battiti al minuto dalla posizione supina a quella eretta 10 , 11 , 12 . Dato che la POTS può essere associata a neuropatia delle piccole fibre o autonomica, può essere eseguita un'ulteriore valutazione diagnostica con test di funzionalità autonomica e/o una biopsia cutanea per la valutazione della neuropatia delle piccole fibre. La POTS è ora nota come una delle molte possibili caratteristiche delle sindromi post-acute da COVID-19 che possono svilupparsi dopo l'infezione da SARS-CoV-2 13 , 14, 15 , 16 . Dato che la vaccinazione COVID-19 suscita una risposta immunologica alla proteina spike della sindrome respiratoria acuta grave coronavirus 2 (SARS-CoV-2), esiste una plausibilità biologica per una risposta sistemica simile, anche se attenuata, al vaccino rispetto a quella osservata da esposizione virale. Pertanto, in questo studio, abbiamo valutato la relazione tra la vaccinazione COVID-19 e le nuove diagnosi correlate alla POTS valutando le probabilità di diagnosi al basale 90 giorni prima della prima esposizione al vaccino rispetto ai successivi 90 giorni dopo l'esposizione al vaccino in un'analisi di sequenza-simmetria 17. Per prima cosa abbiamo confrontato le nuove probabilità di diagnosi correlate a POTS con quelle per la miocardite e per le diagnosi di cure primarie comuni (CPC) per fornire parametri di riferimento che tengano conto del potenziale confondimento derivante dai cambiamenti nell'impegno del paziente con il sistema sanitario durante la pandemia, nonché bias di rilevamento dal punto di vista del fornitore . Abbiamo quindi confrontato i rischi di nuove diagnosi di POTS insorte dopo la vaccinazione rispetto alle nuove diagnosi di POTS insorte dopo un'infezione naturale, per fornire un contesto più ampio per l'interpretazione dei risultati.
Risultati
Per l'analisi post-vaccinazione, abbiamo studiato 284.592 pazienti (età 52 ± 20 anni; 57% donne; 63% bianchi, 10% asiatici, 8,9% afroamericani e 12% ispanici). I tipi di vaccinazioni ricevute includevano: 62% Pfizer-BioNTech (BNT162b2); 31% Moderna (mRNA-1273); 6,9% Johnson & Johnson/Janssen (Ad26.COV2.S); e <0,1% altri vaccini, tra cui AstraZeneca (ChAdOx1-S), Novavax (NVX-CoV2373) e Sinovac (CoronaVac).
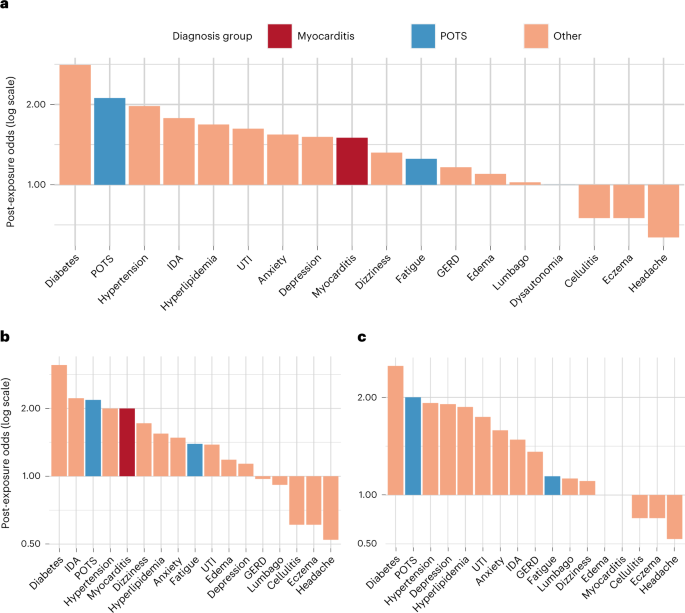
Per le nuove diagnosi fatte dopo la vaccinazione, abbiamo scoperto che le cinque condizioni con le più alte probabilità post-vaccinazione di nuove diagnosi erano miocardite, disautonomia, POTS, sindrome di attivazione dei mastociti e infezione del tratto urinario (UTI). Due condizioni associate a POTS avevano probabilità inferiori, con affaticamento che mostrava un rapporto moderato e sindrome di Ehlers-Danlos (EDS) con il secondo dal rapporto più basso (Fig. 1a e Tabella 1 ). Complessivamente, le probabilità post-vaccinazione di nuove diagnosi associate a POTS ( n = 4.526, probabilità = 1,33 (1,25-1,41), P <0,001) erano superiori rispetto alle diagnosi CPC ( n = 33.590, probabilità = 1,21 (1,18-1,23) , P < 0.001) ma inferiore rispetto alla miocardite ( n = 25, quote = 2,57 (1,02–6,77), P = 0,046). Quando abbiamo ripetuto le analisi intorno al ricevimento della seconda (piuttosto che della prima) dose di vaccinazione, abbiamo osservato risultati complessivamente simili (Tabella Supplementare 1 ). L'odds ratio (OR) delle diagnosi post-vaccino di condizioni POTS associate rispetto a CPC era 1,10 (1,03-1,17), P = 0,003, con risultati simili osservati dalle analisi condotte utilizzando il bootstrapping in cluster (OR = 1,10 (1,02-1,17)) . Pazienti con diagnosi associate a POTS ( n = 1.924) dopo la vaccinazione avevano dati demografici e tipi di vaccino simili rispetto alla popolazione complessiva (età 56 ± 20 anni; 59% donne; 67% bianchi, 9% asiatici e 11% afroamericani e 12% ispanici; 59% Pfizer-BioNTech , 35% Moderna e 6,0% Johnson & Johnson/Janssen). Abbiamo condotto analisi stratificate per sesso e trovato risultati simili tra i sessi per le diagnosi associate a POTS, sebbene l'EDS fosse raramente diagnosticata nei maschi ( n = 5) rispetto alle femmine ( n = 35) (Fig. 1b, c ).
Fig. 1: Probabilità post-vaccinazione per diagnosi.
a , Tutti i pazienti, post-vaccinazione. b , Solo pazienti di sesso maschile, post-vaccinazione. c , Solo pazienti di sesso femminile, post-vaccinazione. GERD, malattia da reflusso gastroesofageo; IDA, anemia sideropenica.
Tabella 1 Diagnosi entro 90 giorni dall'esposizione per il campione di studio con vaccinazione COVID-19 documentata ( n = 284.592)
Per le nuove diagnosi effettuate dopo l'infezione da SARS-CoV-2, abbiamo condotto analisi separate su 12.460 pazienti con infezione da SARS-CoV-2 documentata (età 47 ± 23 anni; 50% donne; 54% bianchi, 6% asiatici e 20% afroamericani). e il 29% di etnia ispanica). Complessivamente, le probabilità post-infezione di nuove diagnosi associate a POTS ( n = 1.004, probabilità = 1,52 (1,33-1,72), P <0,001) erano numericamente superiori a quelle per le diagnosi CPC ( n = 3.325, probabilità = 1,4 (1,31- 1,50), P < 0,001) (Fig. 2 e Tabella 2 ); tuttavia, l'OR non era significativamente più alto (1,08 (0,93-1,25), P = 0,29), potenzialmente correlato alla dimensione limitata del campione. Risultati simili sono stati osservati quando le analisi sono state condotte utilizzando il bootstrap in cluster (OR = 1,08 (0,94–1,26)). I pazienti che hanno ricevuto diagnosi associate a POTS ( n = 686) dopo l'infezione avevano dati demografici simili alla popolazione complessiva di COVID-19 ma erano leggermente più anziani (47% femmine; 59% bianche, 6,1% asiatiche e 22% afroamericane e 26% ispaniche). ; età media 60 ± 20 anni). Simili analisi stratificate per sesso hanno mostrato risultati simili, con il tasso leggermente più alto di miocardite negli uomini non significativo, probabilmente a causa del basso tasso di nuove diagnosi ambulatoriali (tre negli uomini e due nelle donne) (Fig. 2b, c ) .
Fig. 2: Probabilità post-infezione per diagnosi.
a , Tutti i pazienti, post-infezione. b , Solo pazienti di sesso maschile, post-infezione. c , Solo pazienti di sesso femminile, post-infezione. GERD, malattia da reflusso gastroesofageo; IDA, anemia sideropenica.
Tabella 2 Diagnosi entro 90 giorni dall'esposizione per il campione di studio con infezione da SARS-CoV-2 documentata ( n = 12.460)
Per interpretare le probabilità post-esposizione di nuove diagnosi nel contesto della loro frequenza complessiva, abbiamo tracciato sia le probabilità post-esposizione che i tassi assoluti di occorrenza di nuove diagnosi per tutte le condizioni studiate (Fig. 3 ) . Per la coorte post-vaccinazione, le probabilità di nuove diagnosi di POTS, disautonomia e miocardite erano elevate ma con tassi di occorrenza variabilmente bassi. Per la coorte post-infezione, sia le probabilità di nuove diagnosi che il loro tasso di occorrenza tendevano ad essere elevate, in particolare per condizioni come diabete, POTS e ipertensione. Per la maggior parte delle condizioni studiate, i tassi post-infezione erano più alti dei tassi post-vaccinazione. Per le diagnosi associate a POTS, in particolare, il rischio post-infezione era 5,35 (5,05-5,68, P < 0,001) volte superiore dopo l'esposizione all'infezione da SARS-Cov-2 rispetto a dopo l'esposizione alla vaccinazione.
Fig. 3: Illustrazione centrale.
Disegno dello studio (a sinistra) e probabilità di diagnosi post-esposizione rispetto al tasso per 100.000 per infezione da SARS-Cov-2 e vaccinazione COVID-19 (a destra). Per quote e OR nel riquadro di sinistra, il numeratore è indicato dalla freccia, il denominatore dal cerchio. GERD, malattia da reflusso gastroesofageo; IDA, anemia sideropenica.
Discussione
Nella nostra popolazione ampia e diversificata, utilizzando un'analisi di simmetria di sequenza, abbiamo trovato prove evidenti di diagnosi associate a POTS che si verificano più frequentemente dopo la vaccinazione COVID-19 rispetto a prima della vaccinazione. Queste nuove diagnosi POTS si sono verificate a un ritmo più frequente rispetto alle nuove diagnosi CPC dopo la vaccinazione. Tuttavia, il tasso di nuove diagnosi di POTS fatte dopo la vaccinazione era molto meno frequente del tasso di nuove diagnosi di POTS fatte dopo l'infezione da SARS-CoV-2, indicando che i rischi in eccesso rimangono più alti dopo l'infezione che dopo la vaccinazione. Questa stessa tendenza generale di tassi proporzionalmente più elevati di nuove diagnosi dopo l'infezione rispetto a dopo la vaccinazione è stata costantemente osservata per la miocardite, che abbiamo considerato la condizione di riferimento, così come per altre diagnosi più comuni, che abbiamo considerato le condizioni di riferimento.
È stata descritta la POTS che si verifica dopo l'infezione da SARS-CoV-2, ma le segnalazioni di POTS o altre neuropatie dopo la vaccinazione COVID-19 hanno iniziato a emergere solo nei case report 9 , 18 . Rapporti storicamente simili di POTS post-vaccinazione sono apparsi nel contesto della vaccinazione contro il papillomavirus umano 19 , 20 , sebbene senza un follow-up sufficiente o dati di convalida per stabilire la causalità 21 , 22. Allo stesso modo, i nostri risultati non devono essere interpretati come definitivi per eventuali collegamenti causali tra vaccinazione COVID-19 e POTS a causa del disegno osservazionale dello studio. Tuttavia, le osservazioni concordanti di rischi elevati, anche se meno frequenti, per gli stessi tipi di diagnosi fatte dopo la vaccinazione rispetto a quelle fatte dopo l'infezione sono suggestive, con l'esempio prototipico rappresentato dalla miocardite che si è presentata nelle nostre coorti con frequenze corrispondenti a quelle riportate da altri studi 7 , 8 , 23. Inoltre, abbiamo osservato effetti simili nei pazienti che ricevevano principalmente, ma non esclusivamente, vaccini a mRNA. Poiché l'eterogeneità si osserva nelle risposte benefiche alla vaccinazione COVID-19, così come nelle risposte cliniche all'esposizione virale naturale, non sorprende che l'eterogeneità sia osservata per gli effetti fuori bersaglio della vaccinazione 24 .
Esiste una plausibilità biologica per l'associazione tra POTS e vaccinazione COVID-19 in particolare. Prima della pandemia, la vaccinazione mRNA era stata somministrata in piccoli studi che coinvolgevano prevalentemente la terapia del cancro, dimostrando rari effetti neurologici fuori bersaglio come la paralisi di Bell, che è stata osservata anche con la vaccinazione COVID - 1925,26 . Nell'infezione da SARS-CoV-2, segnalazioni multiple di POTS post-infezione invocano la possibilità di un meccanismo immuno-mediato innescato da un componente antigenico della proteina spike condiviso con la vaccinazione 13 , 24 , 27. Data l'ampia espressione dei precettori ACE2, l'attivazione dell'inflammasoma da parte della proteina spike sintetica potrebbe provocare effetti multisistemici, inclusi obiettivi neurocardiogenici e potenziale induzione di tipi variabili di autoimmunità 28 , 29 , 30 . Inoltre, è noto che il rivestimento di nanoparticelle lipidiche nelle formulazioni del vaccino a mRNA è altamente infiammatorio, sebbene gli effetti correlati al rivestimento lipidico sembrino contribuire meno probabilmente rispetto agli effetti mediati dalla proteina spike 31. Sono necessarie ulteriori ricerche per chiarire i potenziali meccanismi correlati alla formulazione del vaccino o al bersaglio del vaccino. Fortunatamente, nel nostro studio, le diagnosi correlate alla POTS sono state osservate a un tasso sostanzialmente inferiore negli scenari post-vaccinazione rispetto agli scenari post-infezione. Abbiamo osservato che i POTS in entrambi gli scenari possono rispondere alle terapie convenzionali. Nella nostra esperienza, i pazienti sono gestiti secondo le linee guida standard di cura 11 , 12per il trattamento della POTS, che prevede terapie inizialmente conservative, come pastiglie di sale e idratazione, programmi di esercizi strutturati e calze compressive. Quando clinicamente indicato, di solito per sintomi sostanziali o persistenti, la terapia farmacologica, come i beta-bloccanti o l'ivabradina, è stata prescritta come tollerata per la risposta tachicardica e la midodrina per l'intolleranza ortostatica. Nei pazienti con varianti iperadrenergiche, è stata somministrata o presa in considerazione la clonidina. Di conseguenza, i pazienti studiati hanno ricevuto cure cliniche che sono state riviste per essere coerenti con le raccomandazioni delle linee guida e il rinvio a esperti locali nella gestione della POTS è stato spesso perseguito in casi che richiedevano una valutazione e terapie più specializzate 11 , 12 .
In sintesi, le diagnosi correlate alla POTS sembrano essere acquisite con maggiore frequenza dopo, rispetto a prima, la vaccinazione COVID-19, in particolare se confrontata con le condizioni più comunemente diagnosticate, ma a un tasso che è circa cinque volte inferiore rispetto a dopo SARS-CoV- 2 infezione. Sono necessarie ulteriori ricerche sulla relazione tra vaccinazione COVID-19 e POTS. Sviluppando ulteriormente la base di prove e aumentando la comprensione degli effetti collaterali dei vaccini emergenti, i ricercatori clinici possono lavorare per aumentare la fiducia medica e migliorare la qualità delle cure, nonché le comunicazioni sui vaccini, con l'obiettivo finale di ottimizzare l'assorbimento del vaccino.
Limiti dello studio
Il nostro studio ha diversi limiti. Ci siamo concentrati sulla raccolta di dati da incontri ambulatoriali e dati esclusi da incontri ricoverati in un singolo centro medico, che riduce al minimo la confusione ma limita la validità esterna. Poiché i pazienti possono anche ricevere cure al di fuori del nostro sistema sanitario, esiste la possibilità che alcune esposizioni non registrate possano aver portato a una classificazione errata. Tuttavia, dato il periodo di tempo dello studio, durante il quale le vaccinazioni tendevano a essere ritardate di 90 giorni dopo l'infezione e durante il quale l'anamnesi vaccinale tendeva a essere diligentemente documentata, gli effetti di eventuali esposizioni non registrate dovrebbero essere minimi. Inoltre, le nostre popolazioni separate di pazienti vaccinati e infetti si escludevano a vicenda; riconoscendo che queste popolazioni possono avere differenze intrinseche, i confronti tra le popolazioni dovrebbero essere interpretati con maggiore cautela rispetto ai confronti all'interno delle popolazioni. Non abbiamo giudicato formalmente tutte le diagnosi a causa dell'elevato numero di eventi e un sottocampione giudicato ha mostrato che un grado significativo di diagnosi non POTS è stato catturato all'interno dei nostri codici di classificazione internazionale delle malattie (ICD); tuttavia, dato che ciò comporterebbe probabilmente un'errata classificazione non differenziale che tende verso il nulla, riteniamo che i nostri confronti relativi rimangano validi. Le nostre analisi, basate sui dati delle cartelle cliniche, potrebbero aver catturato le vaccinazioni in modo più efficace rispetto alle infezioni da SARS-CoV-2, limitando così la dimensione del campione per le analisi relative all'infezione. I nostri criteri di esclusione limitano la generalizzabilità dei nostri risultati nei pazienti che hanno avuto sia la vaccinazione che l'infezione, in entrambi gli ordini. Non abbiamo valutato specificamente le interazioni tra infezione e vaccinazione o effetti temporali potenzialmente derivanti da variazioni stagionali o fattori dinamici che si sono evoluti nel corso della pandemia (ad esempio, infezioni causate da varianti Delta rispetto a Omicron). Dato che la POTS è riconosciuta come una condizione comunemente sottodiagnosticata e mal diagnosticata32 , 33, la nostra ricerca basata sui record potrebbe aver sottovalutato la prevalenza reale. Al contrario, la mancanza di un unico codice ICD standard per l'acquisizione di una diagnosi formale di POTS può portare a sovrapposizioni con altre condizioni mediche e variazioni nell'applicazione dei codici ICD disponibili, inclusa la scelta di quali codici associati a POTS vengono utilizzati. Pertanto, sono necessari studi prospettici che utilizzino metodi più specifici per identificare POTS e condizioni associate per chiarire i tassi assoluti di diagnosi post-esposizione, in contrasto con i confronti relativi principalmente presenti nel presente studio. Infine, poiché ci siamo concentrati sui dati derivati da incontri ambulatoriali che si verificano in un singolo centro medico, sono necessari ulteriori studi in coorti esterne idealmente più ampie e diversificate per valutare la generalizzabilità dei nostri risultati.
Metodi
Questo studio è conforme a tutte le normative etiche pertinenti. Il comitato di revisione istituzionale Cedars-Sinai ha approvato lo studio e ha rinunciato al consenso informato per questo studio retrospettivo. Nessun compenso è stato dato ai partecipanti.
Coorti di studio
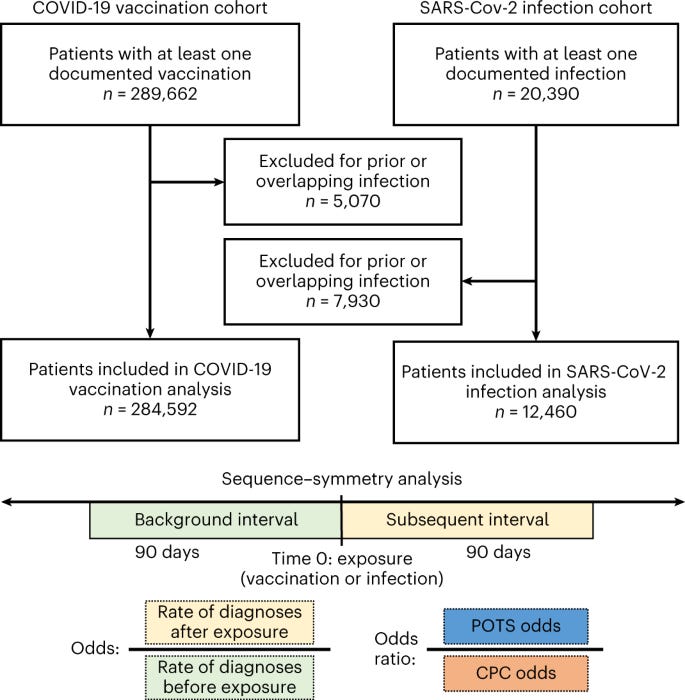
Le nostre coorti di studio sono state derivate dalla diversa popolazione di pazienti del Cedars-Sinai Health System nella contea di Los Angeles, California, dal 2020 al 2022. Il nostro progetto di studio include due analisi di sequenza-simmetria 17 all'interno di coorti retrospettive separate di pazienti con vaccinazione COVID - 19 e pazienti con infezione da SARS-CoV-2.
Coorte post-vaccino
Nella nostra coorte primaria che indagava sulla relazione tra vaccinazione COVID-19 e diagnosi POTS, l'esposizione primaria era la prima vaccinazione COVID-19, come documentato nella cartella clinica elettronica (EHR). Di tutti i pazienti che avevano documentato almeno una dose di vaccinazione COVID-19 ( n = 289.662), abbiamo escluso quelli con infezione da SARS-CoV-2 prima ed entro 90 giorni dalla prima dose di vaccinazione ( n = 5.070). Abbiamo identificato nuove diagnosi che si verificano entro 90 giorni dall'esposizione, associate a un incontro ambulatoriale e definite dai codici ICD-9 e ICD-10 o raggruppate per phecode (Tabella Supplementare 2 ) 34. Abbiamo considerato tre gruppi di diagnosi: diagnosi associate a POTS, miocardite e diagnosi CPC. Data la mancanza di un unico codice ICD per POTS, abbiamo raccolto l'opinione di esperti da specialisti clinici per definire un gruppo di diagnosi associate a POTS che include disautonomia, altre aritmie cardiache specificate (il codice ICD primario, qui indicato come POTS), mastociti sindrome di attivazione e disturbi correlati, EDS e affaticamento. Le diagnosi CPC sono state selezionate in modo prospettico dai codici ICD frequentemente documentati nelle cure primarie 35 , escludendo le diagnosi con una forte plausibilità biologica per essere direttamente correlate a COVID-19 (ad esempio, infezione delle vie respiratorie superiori, tosse e febbre).
Per valutare la validità del nostro approccio all'identificazione di possibili diagnosi di POTS, abbiamo condotto un giudizio clinico su 50 pazienti incontrati in sequenza identificati con entrambi i codici I49.8 e G90.9. Da questo processo di aggiudicazione, abbiamo osservato che 40 (80%) sono stati formalmente confermati POTS attraverso test diagnostici completi o con segni e sintomi coerenti con le definizioni delle linee guida di POTS ma ancora in attesa di test diagnostici completi per la conferma. Abbiamo utilizzato codici ICD limitati ma disponibili nel tentativo di identificare le diagnosi POTS con sensibilità e specificità ottimali, pur riconoscendo che l'errata classificazione può derivare sia da modelli di codifica ICD variabili sia dalla precedente assenza di un codice ICD univoco per POTS. Nonostante i risultati accettabili di aver giudicato clinicamente un sottoinsieme dei nostri casi identificati,
Coorte post-infezione
La coorte secondaria ha studiato la relazione dell'infezione da SARS-CoV-2 con le diagnosi di POTS per il confronto contestuale. Sono stati inclusi tutti i pazienti con infezione documentata da SARS-CoV-2 ( n = 20.390) ed esclusi quelli con vaccinazione prima o entro 90 giorni dall'infezione ( n = 7.930). L'esposizione primaria per la coorte secondaria è stata la prima infezione da SARS-CoV-2. Abbiamo analizzato le stesse diagnosi e gruppi di diagnosi che si verificano entro 90 giorni dalla prima infezione da SARS-CoV-2. Nel progettare il nostro studio, abbiamo osservato aumenti delle probabilità multiple di diagnosi CPC post-COVID-19, in particolare per diabete e ipertensione (non aggiustate per altre diagnosi CPC). L'aumento del diabete e del rischio cardiometabolico è stato precedentemente riportato da coorti separate 36 , 37, 38 , 39 , 40 . Pertanto, abbiamo riconosciuto l'importanza di includere queste diagnosi all'interno del gruppo CPC, dato che rappresentano condizioni comunemente diagnosticate in contesti di assistenza primaria anche se elevate nel contesto post-esposizione per motivi non ancora del tutto chiari. Abbiamo anche riconosciuto che l'aumento del rapporto di rischio per queste diagnosi avrebbe orientato in modo conservativo i nostri risultati comparativi primari verso lo zero.
analisi statistiche
Questo studio è stato progettato per affrontare molteplici potenziali fattori di confusione all'inizio. Data l'origine dati basata su cartelle cliniche con determinati limiti intrinseci ai dati interrogabili a livello di paziente, abbiamo riconosciuto che un progetto autocontrollato consentirebbe almeno una certa capacità di controllo per fattori confondenti invarianti nel tempo, come età e sesso, o fattori confondenti latenti ma invarianti nel tempo che potrebbero riflettere differenze nell'interazione sanitaria tra i pazienti vaccinati e quelli non vaccinati al momento dell'infezione. Abbiamo anche riconosciuto che l'esposizione stessa potrebbe influenzare il comportamento sanitario, ad esempio i pazienti potrebbero sentirsi più a loro agio visitando i medici dopo la vaccinazione. A tal fine, abbiamo confrontato gli eventi di nuove diagnosi di POTS con nuove diagnosi di miocardite (l'evento di riferimento) e con nuove diagnosi di altre condizioni comunemente fatte durante le visite di assistenza primaria (eventi di riferimento). I confronti tra popolazioni con due esposizioni distinte ma distinguibili (vaccinazione e infezione da SARS-CoV-2) potrebbero consentire il controllo del bias di rilevamento dopo l'esposizione. Poiché il nostro set di dati di origine include pazienti che potrebbero aver avuto eventi di infezione o vaccinazione SARS-CoV-2 che si sono verificati al di fuori del nostro sistema sanitario, influenzando potenzialmente gli esiti di interesse, siamo stati attenti a limitare le nostre analisi ai dati raccolti entro un periodo di tempo specifico e limitato prima e dopo l'"evento" di esposizione (ovvero infezione o vaccinazione) dato che non registrato (ovvero, le esposizioni non misurate) potrebbero altrimenti avere maggiori opportunità di esercitare effetti di confusione. Per questo motivo, abbiamo utilizzato un'analisi di sequenza-simmetria insieme a intervalli di tempo ristretti pre-specificati intorno alle esposizioni documentate per ridurre al minimo la possibilità che durante lo stesso periodo di tempo ristretto si siano verificate esposizioni aggiuntive non registrate e potenzialmente confondenti o interagenti.17 . Notiamo che, poiché le nostre popolazioni separate pre-specificate di pazienti vaccinati e infetti si escludevano a vicenda, i risultati delle analisi di confronto condotte tra le popolazioni dovrebbero essere interpretati con maggiore cautela rispetto ai risultati delle analisi di confronto condotte all'interno delle popolazioni.
Abbiamo espresso nuovi eventi di diagnosi come un tasso per 100.000 esposizioni piuttosto che un tasso per numero di periodi di esposizione sequenza-simmetria (ad esempio, due per esposizione), dato che il tasso per esposizione è più facilmente interpretabile clinicamente. Abbiamo utilizzato questi tassi per calcolare due serie di esiti primari. Il primo era la probabilità specifica della diagnosi che la nuova diagnosi si verificasse dopo l'esposizione rispetto a prima dell'esposizione. Il secondo era l'OR dell'acquisizione di una nuova diagnosi di gruppo POTS post-esposizione rispetto a una nuova diagnosi CPC. Le probabilità di diagnosi post-esposizione sono state stimate utilizzando il test delle proporzioni di un campione con correzione della continuità; Gli OR sono stati stimati con regressione logistica con errori standard cluster-robust per tenere conto di possibili misure ripetute (ad esempio, diagnosi multiple) tra i pazienti. Con questi confronti,4 ). Nelle analisi secondarie, abbiamo ripetuto le analisi principali dopo aver scambiato la prima dose di vaccino con la seconda dose di vaccino come esposizione indice. Abbiamo anche ripetuto le analisi OR primarie utilizzando il bootstrap in cluster (2.000 repliche con il normale bootstrap non parametrico). Inoltre, abbiamo eseguito l'aggiudicazione manuale di un sottoinsieme di 50 eventi. La query dei dati è stata eseguita utilizzando DBeaver Enterprise Database Manager versione 22.0.0.202203131528 con la formattazione dei dati da Python 3.9.0 in Jupyter Notebook 6.0.3. Le analisi sono state eseguite utilizzando R/RStudio 4.1.1/2022.02.0 (ref. 41 ) con i pacchetti open source tidyverse versione 1.3.1, janitor versione 2.1.0, lubridate versione 1.8.0, gtsummary versione 1.6.1, knitr 1.39 e ggrepel 0.9.1.
Fig. 4: Disegno dello studio.
Flusso dei partecipanti e progettazione dello studio.
Riepilogo dei rapporti
Ulteriori informazioni sulla progettazione della ricerca sono disponibili nel Nature Portfolio Reporting Summary collegato a questo articolo.
Disponibilità dei dati
I dati clinici che supportano i risultati di questo studio sono disponibili presso il Cedars-Sinai Medical Center su ragionevole richiesta. I dati non sono disponibili pubblicamente a causa dei contenuti che includono informazioni che potrebbero compromettere la privacy/il consenso dei partecipanti alla ricerca. Le informazioni relative alle richieste di accesso ai dati sono disponibili su https://github.com/biodatacore/pots_vax_covid . Tutte le richieste devono essere indirizzate a biodatacore@cshs.org. Il tempo di risposta alle richieste degli autori è di 4 settimane. I dati di origine per figure e codici ICD sono inclusi nei materiali supplementari.
Disponibilità del codice
Il codice per l'analisi condotta per il manoscritto è disponibile su https://github.com/biodatacore/pots_vax_covid .
Riferimenti
Kim, JH, Marks, F. & Clemens, JD Guardando oltre gli studi di fase 3 del vaccino COVID-19. Nat. Med. 27 , 205–211 (2021).
Polacco, FP et al. Sicurezza ed efficacia del vaccino BNT162b2 mRNA Covid-19. N. inglese J.Med. 383 , 2603–2615 (2020).
Baden, LR et al. Efficacia e sicurezza del vaccino mRNA-1273 SARS-CoV-2. N. inglese J.Med. 384 , 403–416 (2021).
Sadoff, J. et al. Sicurezza ed efficacia del vaccino Ad26.COV2.S monodose contro Covid-19. N. inglese J.Med. 384 , 2187–2201 (2021).
Goss, AL, Samudralwar, RD, Das, RR & Nath, A. ANA indaga: complicanze neurologiche dei vaccini COVID-19. Anna. Neurolo. 89 , 856–857 (2021).
Kadali, RA, Janagama, R., Peruru, S. & Malayala, SV Effetti collaterali del vaccino BNT162b2 mRNA COVID-19: uno studio randomizzato e trasversale con sintomi auto-riportati dettagliati dagli operatori sanitari. Int. J. Infettare. Dis. 106 , 376–381 (2021).
Mevorach, D. et al. Miocardite dopo il vaccino mRNA BNT162b2 contro Covid-19 in Israele. N. inglese J.Med. 385 , 2140–2149 (2021).
Bozkurt, B., Kamat, I. & Hotez, PJ Miocardite con vaccini mRNA COVID-19. Circolazione 144 , 471–484 (2021).
Reddy, S., Reddy, S. & Arora, M. Un caso di sindrome da tachicardia ortostatica posturale secondaria al vaccino RNA messaggero COVID-19. Cureo 13 , e14837 (2021).
Vernino, S. et al. Sindrome da tachicardia posturale ortostatica (POTS): stato della scienza e assistenza clinica da un incontro di consenso degli esperti del National Institutes of Health del 2019 - Parte 1. Auton. Neurosci. 235 , 102828 (2021).
Raj, SR et al. Dichiarazione di posizione della Canadian Cardiovascular Society sulla sindrome da tachicardia ortostatica posturale (POTS) e disturbi correlati di intolleranza ortostatica cronica. Potere. J. Cardiolo. 36 , 357–372 (2020).
Sheldon, RS et al. 2015 Dichiarazione di consenso degli esperti della Heart Rhythm Society sulla diagnosi e il trattamento della sindrome da tachicardia posturale, tachicardia sinusale inappropriata e sincope vasovagale. Ritmo cardiaco 12 , e41 – e63 (2015).
Raj, SR et al. Sindrome da tachicardia posturale da COVID lungo: una dichiarazione dell'American Autonomic Society. Clino. Auton. Ris. 31 , 365–368 (2021).
Jamal, SM et al. Valutazione prospettica della disfunzione autonomica nella sequela post-acuta di COVID-19. Marmellata. Coll. Cardio. 79 , 2325–2330 (2022).
Rai, NS, Everin, O. & Manohar, VA Sindrome da tachicardia ortostatica posturale dovuta a COVID-19. Marmellata. Coll. Cardio. 79 , 2197 (2022).
Johansson, M. et al. Sintomi post-COVID-19 a lungo raggio che si presentano come una variante della sindrome da tachicardia ortostatica posturale: l'esperienza svedese. Caso JACC Rep. 3 , 573–580 (2021).
Takeuchi, Y., Shinozaki, T. & Matsuyama, Y. Un confronto di stimatori da serie di casi autocontrollati, design caso-crossover e analisi di simmetria di sequenza per studi farmacoepidemiologici. BMC Med. Ris. Metodol. 18 , 4 (2018).
Safavi, F. et al. Sintomi neuropatici con vaccinazione SARS-CoV-2. Prestampa su https://www.medrxiv.org/content/10.1101/2022.05.16.22274439v1.full.pdf (2022).
Blitshteyn, S. Sindrome da tachicardia posturale a seguito di vaccinazione contro il papillomavirus umano. Euro. J. Neurol. 21 , 135–139 (2014).
Blitshteyn, S. & Brook, J. Sindrome da tachicardia posturale (POTS) con anticorpi anti-recettore NMDA dopo vaccinazione contro il papillomavirus umano. Immunolo. Ris. 65 , 282–284 (2017).
Agenzia europea per i medicinali. Vaccini HPV: l'EMA conferma che le prove non supportano che causino CRPS o POTS. https://www.ema.europa.eu/en/news/hpv-vaccines-ema-confirms-evidence-does-not-support-they-cause-crps-pots (2015).
Barboi, A. et al. Vaccino contro il papillomavirus umano (HPV) e disturbi autonomici: una presa di posizione dell'American Autonomic Society. Clini. Auton. Ris. 30 , 13-18 (2020).
Witberg, G. et al. Miocardite dopo la vaccinazione contro il Covid-19 in una grande organizzazione sanitaria. N. inglese J.Med. 385 , 2132–2139 (2021).
Teijaro, JR & Farber, vaccini DL COVID-19: modalità di attivazione immunitaria e sfide future. Nat. Rev. Immunol. 21 , 195–197 (2021).
Verbeke, R., Lentacker, I., De Smedt, SC & Dewitte, H. Tre decenni di sviluppo del vaccino RNA messaggero. Nano Oggi 28 , 100766 (2019).
Cirillo, N. Effetti avversi orofacciali riportati dei vaccini COVID-19: i noti e gli sconosciuti. J. Pathol orale. Med. 50 , 424–427 (2021).
Goldstein, DS La possibile associazione tra COVID-19 e sindrome da tachicardia posturale. Ritmo cardiaco 18 , 508–509 (2021).
Conceição, C. et al. La proteina della punta SARS-CoV-2 ha un ampio tropismo per le proteine ACE2 dei mammiferi. PLoS Biol. 18 , e3001016 (2020).
Angeli, F., Spanevello, A., Reboldi, G., Visca, D. & Verdecchia, P. SARS-CoV-2 vaccini: luci e ombre. Euro. J. stagista. Med. 88 , 1–8 (2021).
Chen, Y. et al. Fenomeni autoimmuni di nuova insorgenza post-vaccinazione COVID-19. Immunologia 165 , 386–401 (2022).
Ndeupen, S. et al. Il componente delle nanoparticelle lipidiche della piattaforma mRNA-LNP utilizzato negli studi preclinici sui vaccini è altamente infiammatorio. iScienza 24 , 103479 (2021).
Schmidt, LL, Karabin, BL & Malone, AC Sindrome da tachicardia ortostatica posturale (POTS): valutazione, diagnosi e valutazione per il trattamento POTS (ADEPT). integratore Med. Int. 4 , 142–153 (2017).
Kavi, L., Gammage, MD, Grubb, BP & Karabin, BL Sindrome da tachicardia posturale: sintomi multipli, ma facilmente persi. Fr. J. Gen. Pratica. 62 , 286–287 (2012).
Wei, W.-Q. et al. Valutazione di phecode, software di classificazione clinica e codici ICD-9-CM per studi di associazione a livello di fenomeno nella cartella clinica elettronica. PLoS ONE 12 , e0175508 (2017).
Avanti veloce: i primi 50 codici. http://idosteopathicphysicians.org/images/2015_fastforward_internal_medicine_press.pdf (2015).
Ayoubkhani, D. et al. Sindrome post-covid in individui ricoverati in ospedale con covid-19: studio di coorte retrospettivo. BMJ 372 , n693 (2021).
Barrett, CE et al. Rischio di diabete di nuova diagnosi >30 giorni dopo l'infezione da SARS-CoV-2 tra persone di età <18 anni—Stati Uniti, 1 marzo 2020–28 giugno 2021. MMWR Morb . Mortale. Wkly Rep. 71 , 59–65 (2022).
Daugherty SE et al. Rischio di sequele cliniche dopo la fase acuta dell'infezione da SARS-CoV-2: studio di coorte retrospettivo. BMJ 373 , n1098 (2021).
Xie, Y. & Al-Aly, Z. Rischi e oneri del diabete incidente nel lungo COVID: uno studio di coorte. Lancetta Diabete Endocrinolo. 10 , 311–321 (2022).
Xie, Y., Xu, E., Bowe, B. & Al-Aly, Z. Esiti cardiovascolari a lungo termine di COVID-19. Nat. Med. 28 , 583–590 (2022).
Squadra principale R. R: A Language and Environment for Statistical Computing (R Foundation for Statistcial Computing, 2021).
Ringraziamenti
Questo studio è stato sostenuto, in parte, dalle sovvenzioni del National Institutes of Health R01HL139829 (P.-SC), 1OT2OD028190 (P.-SC), K23HL153888 (JEE), K23HL159276 (BNW), R01HL153500 (JW), R01HL151828 (SC) e R01HL131532 (SC); Doris Duke Charitable Foundation sovvenzione 2020059 (ACK); American Heart Association 21CDA851511 (BNW); l'American Society of Nuclear Cardiology 2021 Institute for the Advancement of Nuclear Cardiology Research Award (BNW); lo Smidt Heart Institute (ACK); e la Burns & Allen Chair in Cardiology Research (P.-SC), Cedars-Sinai Medical Center, Los Angeles, California. Gli autori ringraziano i membri del BioDataCore Lab, i gruppi di ricerca CORALE ed EMBARC e il COVID-19 Recovery Program presso Cedars-Sinai per il loro supporto e le idee ponderate sulla ricerca COVID-19.
Informazioni sull'autore
Autori e affiliazioni
Dipartimento di Cardiologia, Smidt Heart Institute, Cedars-Sinai Medical Center, Los Angeles, CA, USA
Alan C. Kwan, Joseph E. Ebinger, Janet Wei, Debbie Teodorescu, Patrick G. Botting, Jesse Navarrette, David Ouyang, Matthew Driver, Peng-Sheng Chen e Susan Cheng
Dipartimento di Medicina, Divisione di Malattie Infettive, Cedars-Sinai Medical Center, Los Angeles, CA, USA
Catherine N. Le, Jillian R. Oft e Rachel Zabner
Dipartimento di Medicina, Divisione di Medicina Cardiovascolare, Brigham and Women's Hospital, Boston, MA, USA
Brian Claggett e Brittany N. Weber
Contributi
ACK, JEE, JW, P.-SC e SC hanno sviluppato i concetti iniziali per il manoscritto. ACK, JEE, DT, PGB, JN, MD, BC e SC hanno eseguito la raccolta, l'analisi e la presentazione dei dati. JEE, JW, CNL, JRO, RZ, DO, MD, BC, BNW, P.-SC e SC hanno fornito supervisione e interpretazione su metodi e risultati clinici, tecnici e statistici. La bozza iniziale è stata scritta da ACK e SC, con tutti gli autori che hanno fornito contributi sostanziali durante il processo di editing. Tutti gli autori hanno dato l'approvazione finale per la pubblicazione.
autore corrispondente
Corrispondenza con Alan C. Kwan .
Dichiarazioni etiche
Interessi conflittuali
Gli autori non dichiarano interessi concorrenti.
Revisione tra pari
Informazioni sulla revisione tra pari
Nature Cardiovascular Research ringrazia Svetlana Blitshteyn, Peter Liu e gli altri revisori anonimi per il loro contributo alla revisione tra pari di questo lavoro.
Informazioni aggiuntive
Nota dell'editore Springer Nature rimane neutrale per quanto riguarda le rivendicazioni giurisdizionali nelle mappe pubblicate e le affiliazioni istituzionali.
Informazione supplementare
Informazione supplementare
Tabelle supplementari 1 e 2
Riepilogo dei rapporti
Dati di origine
Dati di origine Fig. 1
Dati di origine statistica
Dati di origine Fig. 2
Dati di origine statistica
Dati di origine Fig. 3
Dati di origine statistica
Diritti e permessi
Springer Nature o il suo licenziante (ad es. una società o un altro partner) detiene i diritti esclusivi su questo articolo in base a un accordo di pubblicazione con l'autore/i o altro/i titolare/i dei diritti; L'autoarchiviazione dell'autore della versione manoscritta accettata di questo articolo è regolata esclusivamente dai termini di tale contratto di pubblicazione e dalla legge applicabile.
A proposito di questo articolo
Cita questo articolo
Kwan, AC, Ebinger, JE, Wei, J. et al. Rischi apparenti di diagnosi di sindrome da tachicardia posturale ortostatica dopo la vaccinazione COVID-19 e l'infezione da SARS-Cov-2. Nat Cardiovasc Res 1 , 1187–1194 (2022). https://doi.org/10.1038/s44161-022-00177-8
Ricevuto il 22 giugno 2022
Accettato il 31 ottobre 2022
Pubblicato il 12 dicembre 2022
Data di emissioneDicembre 2022
DOIhttps://doi.org/10.1038/s44161-022-00177-8
Condividi questo articolo
Chiunque con cui condividi il seguente link sarà in grado di leggere questo contenuto:
Ottieni un link condivisibile
Fornito dall'iniziativa di condivisione dei contenuti Springer Nature SharedIt
Soggetti
Questo articolo è citato da
Disfunzione autonomica e sindrome da tachicardia posturale ortostatica nella sindrome post-acuta da COVID-19
Arturo Fedorowski
Riccardo Sutton
COVID-19, diabete mellito di tipo 2, genetica endocrina e malattie ipofisarie e surrenali
Costantino A. Stratakis
POTS meno frequenti dopo il vaccino COVID-19 che dopo l'infezione da COVID
Reazioni settimanali (2023)
I rischi di POTS dopo la vaccinazione COVID-19 e l'infezione da SARS-CoV-2: vale la pena provare
Svetlana Blitshteyn
Arturo Fedorowski
Nature Cardiovascular Research ( Nat Cardiovasc Res ) ISSN 2731-0590 (online)
mappa del sito nature.com
A proposito di Nature Portfolio
Scopri i contenuti
Politiche editoriali
Servizi per autori e ricercatori
Biblioteche e istituzioni
Pubblicità e partnership
Sviluppo della carriera
Siti regionali
Gestisci i cookie/Non vendere i miei dati
© 2023 Springer Nature Limited